Assalamu'alaikum wr wb
Anak anak Hebat sebelum memulai pembelajaran awali dengan membaca Basmalah.
Pengertian Asam Basa
dan Garam
Asam dan basa sudah dikenal sejak zaman
dulu. Istilah asam (acid) berasal dari bahasa Latin acetum yang berarti cuka.
Istilah basa (alkali) berasal dari bahasa Arab yang berarti abu. Basa digunakan
dalam pembuatan sabun. Juga sudah lama diketahui bahwa asam dan basa saling
menetralkan. Di alam, asam ditemukan dalam buah-buahan, misalnya asam sitrat
dalam buah jeruk berfungsi untuk memberi rasa limun yang tajam.
Pengertian Asam adalah Asam dalam ilmu kimia
ialah senyawa kimia yang jika dilarutkan dalam air akan menghasilkan
sebuah larutan dengan pH lebih kecil dari 7. Dalam definisi modern, asam
yaitu suatu zat yang bisa memberi proton (ion H+) kepada zat lain
(yang disebut basa), atau bisa menerima pasangan elektron bebas dari suatu
basa.
Basa ialah zat(senyawa) yang
bisa beraksi dengan asam, menghasilkan senyawa yang disebut garam.
Sedangkan basa yaitu suatu zat-zat yang bisa menetralkan asam. Secara
kimia, asam dan basa saling berlawanan. Sifat basa pada umumnya ditunjukkan
dari rasa pahit dan licin.
Dalam ilmu kimia, garam ialah senyawa ionik yang terdiri dari ion positif (kation) dan
ion negatif (anion), sehingga akan membentuk senyawa netral
(tanpa bermuatan). Garam terbentuk dari hasil sebuah reaksi asam dan basa.
Teori Asam
Basa Arrhenius
Teori ini
pertama kalinya dikemukakan pada tahun 1884 oleh Svante August Arrhenius.
Menurut Arrhenius, definisi dari asam dan basa, yaitu:
§ asam adalah
senyawa yang jika dilarutkan dalam air melepaskan ion H+.
§ basa adalah
senyawa yang jika dilarutkan dalam air melepaskan ion OH−.
Gas asam klorida (HCl) yang sangat larut dalam air tergolong asam
Arrhenius, sebagaimana HCl dapat terurai menjadi ion H+dan Cl− di dalam
air. Berbeda halnya dengan metana (CH4) yang bukan asam
Arrhenius karena tidak dapat menghasilkan ion H+ dalam air
meskipun memiliki atom H. Natrium hidroksida (NaOH) termasuk basa Arrhenius,
sebagaimana NaOH merupakan senyawa ionik yang terdisosiasi menjadi ion Na+ dan OH− ketika
dilarutkan dalam air. Konsep asam dan basa Arrhenius ini terbatas pada kondisi
air sebagai pelarut.
Teori Asam Basa Brønsted–Lowry
Pada tahun 1923, Johannes N. Brønsted dan Thomas M. Lowry secara
terpisah mengajukan definisi asam dan basa yang lebih luas. Konsep yang
diajukan tersebut didasarkan pada fakta bahwa reaksi asam–basa melibatkan
transfer proton (ion H+) dari satu zat
ke zat lainnya. Proses transfer proton ini selalu melibatkan asam sebagai
pemberi/donor proton dan basa sebagai penerima/akseptor proton. Jadi, menurut
definisi asam basa Brønsted–Lowry,
§ asam adalah
donor proton.
§ basa adalah
akseptor proton.
Jika ditinjau dengan teori Brønsted–Lowry, pada reaksi ionisasi HCl
ketika dilarutkan dalam air, HCl berperan sebagai asam dan H2O sebagai basa.
HCl(aq) + H2O(l) → Cl−(aq) + H3O+(aq)
HCl berubah menjadi ion Cl− setelah
memberikan proton (H+) kepada H2O. H2O menerima proton
dengan menggunakan sepasang elektron bebas pada atom O untuk berikatan dengan H+ sehingga terbentuk ion hidronium (H3O+).
Sedangkan pada reaksi ionisasi NH3 ketika
dilarutkan dalam air, NH3 berperan
sebagai basa dan H2O sebagai asam.
NH3(aq) + H2O(l) ⇌ NH4+(aq) + OH−(aq)
NH3 menerima proton (H+)
dari H2O dengan menggunakan sepasang elektron bebas pada
atom N untuk berikatan dengan H+ sehingga
terbentuk ion ammonium (NH4+). H2O berubah menjadi
ion OH− setelah memberikan proton (H+) kepada NH3.
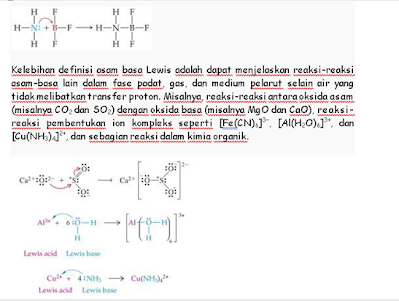
Teori Asam Basa Lewis
Pada tahun 1923, G. N. Lewis mengemukakan teori asam basa yang lebih
luas dibanding kedua teori sebelumnya dengan menekankan pada pasangan elektron
yang berkaitan dengan struktur dan ikatan. Menurut definisi asam basa Lewis,
§ asam adalah
akseptor pasangan elektron.
§ basa adalah
donor pasangan elektron.
Berdasarkan definisi Lewis, asam yang berperan sebagai spesi penerima
pasangan elektron tidak hanya H+. Senyawa yang
memiliki orbital kosong pada kulit valensi seperti BF3 juga dapat berperan sebagai asam. Sebagai
contoh, reaksi antara BF3 dan NH3 merupakan reaksi asam–basa, di mana BF3 sebagai asam Lewis dan NH3 sebagai basa Lewis. NH3 memberikan pasangan elektron kepada BF3 sehingga membentuk ikatan kovalen
koordinasi antara keduanya.
klasifikasi asam dan basa, Keduanya digolongkan berdasarkan kekuatannya dan terionisasi, yang kemudian dibagi menjadi 2, di antaranya:
1. Asam kuat dan basa kuat
Asam kuat adalah senyawa yang terurai secara keseluruhan saat di larutkan di dalam air dan menghasilkan jumlah ion seluruhnya.
Contohnya: HCL, HNO3, H2SO4, HCIO4
Basa kuat adalah senyawa yang terurai secara keseluruhan saat dilarutkan ke dalam air.
Contohnya: NaOH, KOH, Ba(OH)2
2. Asam lemah dan Basa lemah
Asam lemah adalah senyawa yang sedikit terurai saat dilarutkan di dalam air.
Contohnya: H3PO4, H2SO3, HNO2, CH3COOH
Basa lemah adalah senyawa yang hanya sedikit terurai saat dilarutkan ke dalam air.
Contohnya: NaHCO3, NH4OH
Kemudian ada lagi nih Squad, yaitu berdasarkan bentuk ion, berikut di antaranya:
- Asam anion adalah asam yang mempunyai muatan negatif. Contohnya: SO3-
- Asam kation adalah asam yang mempunyai muatan positif. Contohnya: NN4+
- Basa anion adalah basa yang mempunyai muatan negatif. Contohnya: CI-, CN-
- Basa kation adalah basa yang mempunyai muatan positif. Contohnya: Na+, Ca2+
Asam dan basa merupakan dua senyawa
kimia yang sangat penting dalam kehidupan sehari-hari kita.
Secara umum, zat–zat yang memiliki rasa masam itu mengandung asam, misalnya
asam sitrat pada jeruk, asam asetat pada cuka makanan, serta asam benzoat yang
digunakan sebagai pengawet makanan.
Kemudian, basa adalah senyawa yang mempunyai sifat licin,
rasanya pahit seperti obat dan sabun, kemudian ada beberapa jenis basa
yang bersifat korosif (penyebab karat) dan kausatik (merusak kulit).
Meskipun asam dan basa dapat dibedakan dari rasanya, tetapi tidak
disarankan lho ya (dilarang) untuk mencicipi asam atau basa
yang ada di laboratorium, berbahaya, nanti kamu kenapa-kenapa lagi, soalnya
kandungannya itu beda.
Asam dan Basa dapat dibedakan melalui
indikator asam basa, yaitu alat penguji asam basa. Larutan
asam dan basa dapat diperoleh dengan melarutkan asam atau basa secara langsung
ke dalam air. Selain itu, larutan ini juga dapat diperoleh melalui reaksi
antara senyawa oksida dengan air.
Menentukan suatu larutan itu
mengandung asam atau basa caranya, yaitu dengan menggunakan indikator asam basa. Indikator itu merupakan
suatu senyawa kompleks yang bisa bereaksi dengan asam dan basa. Dengan indikator, kita jadi bisa mengetahui suatu zat
bersifat asam atau basa. Nah indikator sendiri terbagi menjadi beberapa
jenis, yaitu indikator alami, indikator universal, dan yang paling umum digunakan adalah kertas
lakmus dan pH meter.
1. Indikator alami
Kamu
tahu apa itu indikator alami? Indikator alami itu adalah indikator yang dibuat
menggunakan ekstrak tumbuhan-tumbuhan seperti bunga,
umbi, kulit buah, juga daun-daun berwarna. Nah contoh spesifiknya itu kunyit, kubis merah, kubis ungu, bunga sepatu,
bunga mawar, bayam merah, geranium.
2. Indikator universal
Berbeda
dengan indikator alami, indikator universal merupakan campuran dari berbagai
macam indikator yang dapat menunjukkan pH (power of hydrogen) suatu
larutan dari perubahan warnanya. Untuk menunjukkan keasaman dan kebasaan, kamu
bisa lihat pada rentang pH 1-14. komponen indikator universalnya.
3. pH meter
Berbeda dari indikator alami dan indikator universal, pH meter merupakan
sebuah alat elektronik atau bisa dikatakan alat yang lebih modern untuk
mengukur pH (derajat keasaman atau kebasaan) suatu cairan (ada elektroda khusus
yang berfungsi untuk mengukur pH bahan-bahan semi-padat). Nih,
gambarnya seperti di bawah ini.
Contoh Soal dan Pembahasan
Tentukan manakah asam dan basa dalam reaksi asam–basa
berikut dengan memberikan alasan yang didasarkan pada teori asam basa
Arrhenius, Brønsted–Lowry, atau Lewis.
1. HCN(aq) + H2O(l) ⇌ CN−(aq) + H3O+(aq)
2. Ni2+(aq) + 4CN−(aq) ⇌ [Ni(CN)4]2−(aq)
Jawab:
1. Berdasarkan teori asam basa Arrhenius, HCN adalah asam
Arrhenius sebagaimana HCN akan melepaskan ion H+ jika dilarutkan dalam air.
Berdasarkan teori Brønsted–Lowry, HCN adalah asam Brønsted–Lowry karena
mendonorkan proton (H+) sehingga menjadi ion CN− sedangkan H2O adalah basa
Brønsted–Lowry karena menerima proton sehingga membentuk ion H3O+.
Berdasarkan teori Lewis, H2O adalah basa
Lewis karena mendonorkan pasangan elektron kepada ion H+ yang berasal dari molekul HCN membentuk ion H3O+ sedangkan H+ dari HCN adalah asam Lewis karena menerima
pasangan elektron dari atom O pada H2O.
2. Teori Arrhenius dan teori Brønsted–Lowry tidak dapat menjelaskan
reaksi ini.
Berdasarkan teori Lewis, CN− adalah basa
Lewis karena mendonorkan pasangan elektron kepada ion Ni2+ sehingga terbentuk ikatan kovalen koordinasi
sedangkan Ni2+ adalah asam Lewis karena menerima pasangan
elektron dari CN−.
Silahkan Isi Presensi disini https://forms.gle/S9N4mNhxxV1Dyn9m9
sumber bacaan:
https://www.gurupendidikan.co.id/asam-basa-dan-garam/
https://blog.ruangguru.com/mengenal-sifat-dan-klasifikasi-asam-basa